Kation rtęci(I)
 Rtęć (Hg, łac. hydrargyrum, z gr. ὑδράργυρος hydrargyros) – pierwiastek chemiczny z grupy metali przejściowych w układzie okresowym. Rtęć jest jedynym metalem występującym w warunkach normalnych w stanie ciekłym.
Rtęć (Hg, łac. hydrargyrum, z gr. ὑδράργυρος hydrargyros) – pierwiastek chemiczny z grupy metali przejściowych w układzie okresowym. Rtęć jest jedynym metalem występującym w warunkach normalnych w stanie ciekłym.
Własności
Rozpuszcza metale, tworząc amalgamaty (z wyjątkiem żelaza, platyny, wolframu i molibdenu). Wykazuje dużą lotność – w temperaturze 20°C w powietrzu znajduje się 14 mg Hg na m³ w stanie równowagi dynamicznej. Dawka progowa rtęci, czyli stężenie uważane za bezpieczne wynosi 0,05 mg Hg na m³ powietrza, dlatego rozlana rtęć stanowi potencjalne niebezpieczeństwo zatrucia.
Kationy rtęci Hg2+ oraz Hg22+ różnią się właściwościami. Kation Hg22+ należy do I grupy kationów, natomiast Hg2+ do II.
Zastosowanie w formie ciekłej
Dzięki swoim właściwościom znalazła zastosowanie do wypełniania termometrów, barometrów, manometrów, pomp próżniowych, itp. Duże ilości rtęci zużywane są do wydobywania złota i srebra, oraz do elektrolizy litowców i produkcji materiałów wybuchowych.
Oprócz tego jest stosowana:
- do produkcji farb okrętowych
- w medycynie i przemyśle farmaceutycznym
- do wykonywania plomb dentystycznych
- przy produkcji świetlówek
W starożytności rtęci używano do produkcji luster. W związku z tym wielu ludzi chorowało z powodu zatrucia tym metalem.
Związki rtęci
Wiele związków rtęci ma szerokie zastosowanie:
- chlorek rtęci(I) – kalomel, stosowany jest w lecznictwie, do wyrobu elektrod, jako środek ochrony roślin
- chlorek rtęci(II) – sublimat, służy jako katalizator w syntezie organicznej, w metalurgii, jako środek dezynfekujący.
Alkaliczny roztwór jodortęcianu potasu K2[HgI4] – odczynnik Nesslera – używany jest do wykrywania amoniaku. Piorunian rtęci Hg(CNO)2 ma zastosowanie do wyrobu spłonek i detonatorów.
źródło: wikipedia.pl (http://pl.wikipedia.org/wiki/Rt%C4%99%C4%87)
Analiza jakościowa
1) Reakcja z wodą amoniakalną.
Kationy z amoniakiem dają czarny osad, skład tego osadu jest jednak różny:
![]()
Osad azotanu oksoamidodirtęci nie rozpuszcza się w nadmiarze amoniaku.
2) Reakcja z wodorotlenkiem sodu
Z roztworu soli rtęci(I) strąca się czarny osad złożony z tlenku rtęci(II) i metalicznej rtęci:
![]()
Osad jest nierozpuszczalny w nadmiarze odczynnika.
3) Reakcje z jodkiem potasu
Jony jodkowe wytrącają żółto-zielony osad dijodku rtęci rozkładający się w nadmiarze odczynnika z wydzieleniem metalicznej rtęci oraz utworzeniem bezbarwnego tetrajodortęcianu(II).
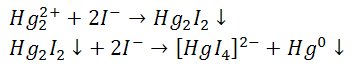
4) Reakcje z chlorkiem cyny(II)
Chlorek cyny(II) redukuje jony rtęci(I) do metalicznej rtęci. Reakcja zachodzi również z osadem chlorku rtęci(I). Przebiega ona intensywnie w środowisku alkalicznym.
![]()





