Anion chlorkowy
Chlorek sodu (NaCl) – nieorganiczny związek chemiczny, sól kwasu chlorowodorowego i sodu(czasami zapisuje się również ją jako sól kwasu solnego i wodorotlenku sodu (HCl + NaOH → NaCl + H2O), stanowiący podstawowy składnik soli kuchennej i soli warzonej. Woda morska to roztwór chlorku sodu.
Chlorek sodu jest białą substancją krystaliczną, dobrze rozpuszczalną w wodzie, jednak o niewielkim stężeniu maksymalnym, słabo higroskopijną. Krystalizuje w układzie regularnym.
Głównym surowcem do pozyskania chlorku sodu jest sól kamienna, nazywana w mineralogii halitem. Halit jest pozyskiwany głównie metodami kopalnymi. Otrzymuje się go także poprzez odparowanie wody morskiej.
To chlorek sodu powoduje, że woda morska jest słona. Wchodzi także w skład płynu pozakomórkowego organizmów żywych. W kuchni jest używany do solenia potraw (przyprawa), a w przemyśle spożywczym używany jako naturalny środek konserwujący. Jest również jednym z ważniejszych związków chemicznych w przemyśle chemicznym.
Jest używana podczas zimy do topnienia lodu, gdyż jej roztwór ma niższą temperaturę topnienia.
Chlorek srebra (AgCl) – nieorganiczny związek chemiczny, sól kwasu chlorowodorowego i srebra. Ta biała sól jest znana ze swojej wyjątkowo niskiej rozpuszczalności w wodzie (podobnie jak chlorek ołowiu(II) i chlorek talu(I)).
Chlorek srebra jest związkiem światłoczułym. Rozkłada się pod wpływem światła lub ogrzewania. W wyniku rozkładu wydziela się gazowy chlor (Cl2) oraz metaliczne srebro, które nadaje substancji szarą lub purpurową barwę. Chlorek srebra występuje w przyrodzie jako minerał chlorargyryt.
Chlorek ołowiu(II) (PbCl2) – nieorganiczny związek chemiczny, sól chlorkowa ołowiu. W temperaturze pokojowej jest to biała, krystaliczna substancja. Jest trudno rozpuszczalny w wodzie i etanolu.
Chlorek rtęci(I) (Hg2Cl2, nazwa zwyczajowa: kalomel gr. kalós = piękny + mėlas = czarny, dawniej: chlorek rtęciawy) – nieorganiczny związek chemiczny – sól kwasu solnego i rtęci na I stopniu utlenienia.
W temperaturze pokojowej jest to biała substancja krystaliczna, w przeciwieństwie do innych soli rtęci nietoksyczna dla ludzi, ale toksyczna dla niektórych zwierząt, nierozpuszczalna w wodzie.
Kalomel jest stosowany m.in. do wyrobu elektrod, do barwienia porcelany, jako środek ochrony roślin, dawniej w bardzo małych ilościach czasem jako środek przeczyszczający.
źródło: Wikipedia.pl
Analiza jakościowa
1) Reakcje z azotanem(V) srebra
Azotan(V) srebra wytrąca z roztworów soli chlorkowych biały osad chlorku srebra.
![]()
Osad ten w świetle przybiera barwę szaro fioletową na skutek powstania metalicznego srebra (reakcja fotochemiczna).
2) Reakcja z manganianem(VII) potasu
W środowisku kwaśnym manganian(VII) potasu nie utlenia w warunkach pokojowych jonów chlorkowych. Reakcja utleniania zachodzi w podwyższonej temperaturze, w środowisku stężonego kwasu siarkowego(VI).
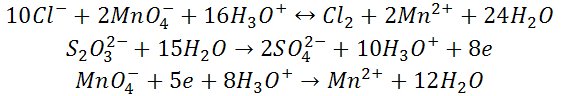
3) Reakcja charakterystyczna
Reakcją charakterystyczną jonu chlorkowego jest ciemnienie wytrąconego osadu chlorku srebra na świetle.
![]()




