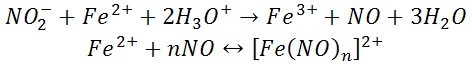Anion azotanowy(III)
Azotan(III) potasu (dawniej azotyn potasu KNO2) – nieorganiczny związek chemiczny, sól, kwasu azotowego(III) i potasu.
Otrzymuje się go przez redukcję ołowiem azotanu(V) potasu:
- KNO3 + Pb → KNO2 + PbO
lub w wyniku jego rozkładu termicznego:
- 2KNO3 → 2KNO2 + O2
Azotan(III) potasu jest białą lub żółtawą, higroskopijną substancją stałą. Jego gęstość wynosi 1,92 g/cm³. Bardzo dobrze rozpuszcza się w wodzie (w temp 20°C 281 g na 100 cm³ H2O, w temp. 100°C 413 g na 100 cm³). Roztwór ma odczyn lekko zasadowy. Temperatura topnienia azotanu(III) potasu wynosi 440°C. Powyżej tej temperatury rozkłada się:
- 4KNO2 → 2K2O + 2N2 + 3O2
Jest utleniaczem, choć w pewnych warunkach może wykazywać właściwości redukujące (por. właściwości azotanów(III)).
Azotan(III) potasu jest w większych ilościach toksyczny. LD50królik(doustnie) wynosi 200 mg/kg). Poza tym, w wyniku reakcji KNO2 z aminami powstającymi w wyniku rozkładu białek w organizmie mogą tworzyć się rakotwórcze nitrozoaminy.
Azotan(III) potasu jest używany do nitrozowania, w produkcji barwników azowych, w chemii analitycznej do określania rzędowości amin, w fotografii jako sensybilizator (uczulacz), a także do konserwacji mięsa (lista E – E249), gdyż zapobiega tworzeniu się jadu kiełbasianego. Ze względu na szkodliwość azotanów(III) sugeruje się ograniczenie ich używania jako konserwantów, jednak całkowite zastąpienie innymi związkami nie jest możliwe.
Azotan(III) sodu (NaNO2, dawniej azotyn sodu) – nieorganiczny związek chemiczny, sól sodowa kwasu azotowego(III), stosowany jako substrat przy produkcji barwników, oraz jako dodatek konserwujący do żywności.
W temperaturze pokojowej jest to biała lub żółtawa substancja stała. W temperaturze 271°C topnieje, w 320°C rozkłada się. Dobrze rozpuszczalna w wodzie. W wyniku hydrolizy anionowej odczyn jej roztworu jest zasadowy:
NaNO2 → Na+ + NO2–
NO2– + H2O ↔ HNO2 + OH–
Azotan (III) amonu – nieorganiczny związek chemiczny, sól amonowa kwasu azotowego(III) o wzorze sumarycznym: NH4NO2. Jest substancją barwy białej.
W laboratorium jest wykorzystywany do otrzymywania wysokiej czystości azotu, poprzez jego termiczny rozkład:
NH4NO2 → 2H2O + N2↑
źródło: Wikipedia.pl
Analiza jakościowa
1) Reakcja z azotanem(V) srebra
Azotan(V) srebra wytrąca biały osad azotanu(III) srebra jedynie z roztworów bardzo stężonych (s=2,6∙10-2 mol/l).
![]()
2) Reakcje z kwasem siarkowym(VI)
Kwas siarkowy(VI) reaguje z jonem azotanowym(III) zgodnie z równaniami reakcji:
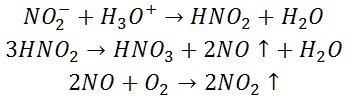
Z powyższych równań reakcji wynika, że w środowisku kwaśnym obok jonów azotanowych(III) (o malejącym stężeniu) istnieją jony azotanowe(V). O obecności jonów azotanowych(III) świadczy zapach tlenków azotu oraz pojawienie się (po kilkunastu sekundach) brunatnego dymu (ditlenku azotu).
3) Reakcje z manganianem(VII) potasu
W środowisku kwaśnym manganian(VII) potasu utlenia jony azotanowe(II) do jonów azotanowych(V) zgodnie z równaniem reakcji:
![]()
4) Reakcje z jodkiem potasu
Jodek potasu w środowisku kwaśnym redukuje jony azotanowe(III) do tlenku azotu(II):
![]()
Z powyższych równań reakcji wynika, że w środowisku kwaśnym obok jonów azotanowych(III) (o malejącym stężeniu) istnieją jony azotanowe(V). O obecności jonów azotanowych(III) świadczy zapach tlenków azotu oraz pojawienie się (po kilkunastu sekundach) brunatnego dymu (ditlenku azotu).
5) Reakcja charakterystyczna
Na jon azotanowy(III) jest taka sama jak na jon azotanowy(V) z tym, że zachodzi ona już w środowisku słabo kwaśnym od kwasu octowego. Pozwala to odróżnić jon azotanowy(III) od jonu azotanowego(V), ponieważ gęstość kwasu octowego jest zbliżona do gęstości wody, więc w reakcji charakterystycznej nie otrzymujemy obrączki (nie ma granicy fazy), lecz brunatne zabarwienie całego roztworu.