Kation strontu
 Stront (Sr, łac. strontium) – pierwiastek chemiczny z grupy metali ziem alkalicznych w układzie okresowym.
Stront (Sr, łac. strontium) – pierwiastek chemiczny z grupy metali ziem alkalicznych w układzie okresowym.
Pierwiastek ten posiada 23 izotopy z przedziału mas 79-98. Trwałe są cztery z nich – 84, 86, 87 i 88, które też stanowią naturalny skład izotopowy tego pierwiastka. Promieniotwórczy izotop 90Sr jest jednym z najgroźniejszych produktów wybuchów jądrowych. Gromadzi się w tkance kostnej, emituje silne promieniowanie β, a jego czas połowicznego zaniku wynosi aż 29 lat.
Występuje w skorupie ziemskiej w ilościach 370 ppm, w postaci dwóch minerałów – celestyn (siarczan) i stroncjanit (węglan).
Stront został uznany za pierwiastek w 1790 roku przez A. Crawforda, wyodrębniony przez H. Davy’ego w Londynie. Nazwa pochodzi od szkockiej miejscowości Strontian.
Tworzy tlenki, wodorotlenki, fluorki oraz sole kwasów organicznych.
Znaczenie biologiczne – żadne. Pierwiastek ten może być tak samo przyswajany jak wapń przez organizm i zastępować go we wszystkich funkcjach, np. wbudowywując się w tkankę kostną. Gdy wchłaniane są jego izotopy stabilne, wówczas nie ma to żadnego wpływu na fukcjonowanie organizmu. Gdy jednak jest to izotop 90Sr, wówczas pozostaje on długo w organizmie i napromieniowuje go od wewnątrz przez długie lata uniemożliwiając skuteczne przeprowadzenie odkażenia organizmu po jego wchłonięciu.
Stront jest srebrzystoszarym, miękkim metalem. Na jego powierzchni, tak jak to jest w przypadku glinu, tworzy się ochronna warstwa tlenków. Oczyszczona powierzchnia jest jednak bardzo reaktywna – czysty stront reaguje wybuchowo z wodą i może zapalić się na powietrzu.
Stront w czystej postaci jest stosowany jako dodatek do niektórych gatunków szkła – np. stosowanych do produkcji ekranów telewizyjnych. Ze względu na to, że barwi płomień intensywnym, karmino-czerwonym kolorem jego sole są dodawane do ogni sztucznych i rakiet sygnałowych.
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/Stront)
Analiza jakościowa
1) Reakcje z węglanami
Jony strontu reagują z węglanami, tworząc biały osad.
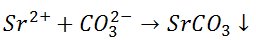
Węglany strontu rozpuszczają się w rozcieńczonych kwasach z wydzieleniem lotnego dwutlenku węgla.
![]()
2) Reakcja z kwasem siarkowym(VI)
Wytrąca się biały osad siarczanu(VI) strontu, częściowo rozpuszczalny w rozcieńczonych mocnych kwasach, nierozpuszczalny w siarczanie amonu.
![]()
3) Reakcja z jonami szczawianowymi
Jony szczawianowe wytrącają biały osad szczawianu strontu, rozpuszczalny w kwasie solnym i kwasie octowym.
![]()
4) Reakcja z jonami chromianowymi(VI)
Jony chromianowe wytrącają żółty, krystaliczny osad chromianu(VI) strontu, rozpuszczalny już w kwasie octowym.
![]()








