Anion jodkowy
Jodek potasu (Kalii Iodum) – jest to nieorganiczny związek chemiczny, połączenie jodu z potasem, tworzący bezbarwne kryształy łatwo rozpuszczalne w wodzie.
Jodek srebra (AgI) – nieorganiczny związek chemiczny, sól kwasu jodowodorowego i srebra. Jest solą o żółtym zabarwieniu, nierozpuszczalną w wodzie i, podobnie jak inne halogenki srebra, światłoczułą. Struktura krystaliczna jodku srebra zmienia się wraz z temperaturą.
Trijodek azotu (jodek azotu, amoniakat trijodku azotu, NI3) – nieorganiczny związek chemiczny azotu i jodu. Jest substancją niezwykle niestabilną, rozkładającą się w sposób wybuchowy pod wpływem lekkiego dotyku.
Reakcję rozkładu trijodku azotu ilustruje równanie:
- 2NI3 (cs) → N2 (g) + 3I2 (g)
Czysty trijodek azotu jest w warunkach normalnych ciemnym brunatno-fioletowym proszkem lub kryształkami. Czysty NI3 po raz pierwszy został uzyskany w 1990 w wyniku reakcji azotku boru z roztworem fluorku jodu w trichlorofluorometanie w temperaturze -30°C.
Zazwyczaj występuje jako czarny amoniakat (NI3•NH3) powstały w wyniku reakcji roztworu jodu z wodą amoniakalną. Pierwszy raz został otrzymany w 1812 Jego budowa została potwierdzona w 1905 r.[2] Struktura krystaliczna amoniakatu składa się z zygzakowatych łańcuchów złożonych z współwierzchołkowych tetraedrów NI4. Pomiędzy łańcuchami ulokowane są cząsteczki amoniaku.
Małe ilości trijodku azotu są syntetyzowane w celu demonstracji dla uczniów. Jednak z powodu wysokiej niestabilności nie jest stosowany do wyrobu spłonek, ani detonatorów do materiałów wybuchowych. Suchy – wybucha przy minimalnym bodźcu mechanicznym, np. dotknięciu ptasim piórem, dlatego wszelkie manipulacje należy przeprowadzać z substancją zwilżoną wodą. NI3•NH3 zostawia po wybuchu pomarańczowe do fioletowych plamy jodu trudne do zmycia wodą (można je usunąć roztworem tiosiarczanu sodu).
źródło: Wikipedia.pl
Analiza jakościowa
1) Reakcja z azotanem(V) srebra
Azotan(V) srebra strąca z roztworów zawierających jony jodkowe żółty osad jodku srebra , nierozpuszczalny w wodzie amoniakalnej.
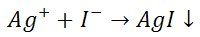
2) Reakcja z manganianem(VII) potasu
W środowisku kwaśnym manganian(VII) potasu utlenia jony jodkowe do wolnego jod. Jeżeli użyjemy dużego nadmiaru jonów jodkowych w stosunku do jonów manganianowych(VII) to roztwór uzyska barwę brązową.
![]()


