Kation cyny(II i IV)
Cyna (Sn, łac. stannum) – pierwiastek chemiczny, metal z bloku p w układzie okresowym.
Cyna tworzy odmiany alotropowe. W warunkach normalnych występuje w odmianie β (beta) zwanej cyną białą, trwałej powyżej 13,2°C. Odmiana ta na ma sieć krystaliczną układzie tetragonalnym, o gęstości 7,3 g/cm³. W temperaturach niższych przechodzi w odmianę regularną α (alfa) o gęstości 5,85 g/cm³. Zmiana gęstości jest równoznaczna ze zmianą objętości, co powoduje, że cyna rozpada się, tworząc szary proszek zwany cyną szarą. Zjawisko to nazywane jest zarazą cynową. Czysta cyna biała jest ciągliwa i kowalna, odporna na korozję.
Ze względu na dostępność, niską temperaturę topnienia, łatwość odlewania, dobre własności mechaniczne a także niską cenę cyny, przedmioty cynowe były niegdyś bardzo popularne od wczesnego średniowiecza, największy rozkwit przedmiotów z cyny nastąpił pomiędzy XIV i XVI w.
Cynę używa się do pokrywania innych metali cienką warstwą antykorozyjną. Proces cynowania stosowany jest do zabezpieczania stalowych naczyń stosowanych w przemyśle spożywczym np. puszek do konserw oraz konwi na mleko.
Największe złoża cyny mieszczą się w Indonezji, Chinach, Tajlandii, Boliwii, Malezji, Rosji, Brazylii, Birmie i Australii.
Stop cyny i ołowiu ma niską temperaturę topnienia (np. przy 60% cyny jest to temperatura ok. 180°C) i stosowany jest w przemyśle i elektrotechnice jako lutowie do łączenia innych metali poprzez lutowanie. Używany był także do wyrobu czcionek drukarskich.
Stop cyny i miedzi to brąz.
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/Cyna)
Analiza jakościowa
1) Reakcja z amoniakiem
Powstają białe osady wodorotlenków.
2) Reakcja z roztworem wodorotlenku sodu
Wytrącają się białe osady wodorotlenków, rozpuszczalne w nadmiarze odczynnika.
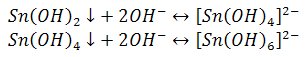
3) Reakcje redukcji
Reakcja prowadzi do otrzymania lotnego cynowodoru, barwiącego utleniającą część palnika gazowego na charakterystyczny niebieski kolor.
4) Reakcje z chlorkiem rtęci(II)
Chlorek rtęci(II) w środowisku kwaśnym redukuje się do białego osadu kalomelu. Wobec nadmiaru cyny(II) następuje dalsza redukcja, aż do wydzielenia metalicznej rtęci (osad czarnieje).
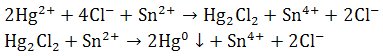
5) Reakcja z wodorotlenkiem bizmutu(III)
Wodorotlenek bizmutu(III) w środowisku alkalicznym ulega pod wpływem cyny(II) redukcji do metalicznego bizmutu (czarny osad).
![]()
6) Reakcja z kwasem molibdenowym
Reakcja prowadzi do otrzymania błękitu molibdenowego.










