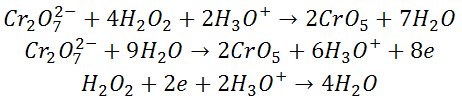Anion chromianowy(VI) i dichromianowy(VI)
Chromian(VI) potasu (K2CrO4) – nieorganiczny związek chemiczny, sól kwasu chromowego i potasu.
W temperaturze pokojowej jest to jasnożółte ciało krystaliczne, masie cząsteczkowej 194,19 g/mol i gęstości 2,73 g/cm3. Dobrze rozpuszcza się w wodzie (62,5 g w 100 cm³ wody przy 20°C) i nie rozpuszcza się w etanolu. Krystalizuje w układzie rombowym. Temperatura topnienia 971°C; rozkłada się przed osiągnięciem temperatury wrzenia. Związek ten jest silnym utleniaczem. W roztworze wodnym, po dodaniu kwasu przechodzi w dichromian(VI) potasu, zmieniając barwę z żółtej na pomarańczową:
2CrO42- + 2H+ → Cr2O72- + H2O
Chromian potasu jest używany głównie w garbarstwie, przemyśle tekstylnym, emalierstwie, przy produkcji barwników i w chemii analitycznej. Podobnie jak inne związki chromu(VI) jest toksyczny. Związki chromu(VI) – w przeciwieństwie do chromu(III) – są uważane za silnie toksyczne i stanowią jeden z najtoksyczniejszych składników ścieków z garbarni.