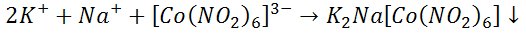Kation potasu
 Potas (K, łac. kalium) – pierwiastek chemiczny z grupy metali alkalicznych w układzie okresowym.
Potas (K, łac. kalium) – pierwiastek chemiczny z grupy metali alkalicznych w układzie okresowym.
Został odkryty i wyodrębniony w 1807 r. przez sir H. Davy’ego .
Trwałe izotopy to 39K oraz 41K. Ważnym nietrwałym izotopem jest 40K, z którego zależnie od sposobu przemiany powstaje 40Ar lub 40Ca.
Główne minerały to sylwin, sylwinit, karnalit, kainit, langbeinit i różne glinokrzemiany.
Ważne związki potasu to tlenek potasu, nadtlenek potasu, wodorotlenek potasu, będący bardzo silną zasadą oraz wiele soli. Prawie wszystkie sole potasu są dobrze rozpuszczalne w wodzie. Potas tworzy także wodorek. Ważnym odczynnikiem chemicznym jest nadmanganian potasu.
Potas jest bardzo aktywnym pierwiastkiem. W kontakcie z wodą i kwasami zapala się i często wybucha. O ile jego powierzchnia nie jest spasywowana w kontakcie z powietrzem zapala się.
Kationy potasu są głównymi jonami wewnątrzkomórkowymi i są konieczne do utrzymania potencjału czynnościowego błon komórkowych (patrz: znaczenie biologiczne pierwiastków).
Kationy K+ należą do V grupy kationów i barwią płomień na kolor różowo-fioletowy.
Jako pierwszy polską nazwę – potas – zaproponował Filip Walter.
Przechowuje się go w nafcie lub oleju parafinowym (najlepiej pod warstwą argonu).
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/Potas)
Analiza jakościowa
1) Barwienie płomienia
Lotne sole potasu barwią płomień palnika na fioletowo.
2) Reakcja z azotynokobaltanem(III) sodu
Azotynokobaltan(III) sodowy w środowisku słabo kwaśnym od kwasu octowego reaguje z jonem potasu tworząc żółty, krystaliczny osad azotynokobaltanu(III) sodowo-potasowego.