Kation wapnia
 Wapń (Ca, łac. calcium) – pierwiastek chemiczny z grupy metali ziem alkalicznych w układzie okresowym.
Wapń (Ca, łac. calcium) – pierwiastek chemiczny z grupy metali ziem alkalicznych w układzie okresowym.
Izotopy stabilne wapnia to 40Ca, 42Ca, 43Ca, 44Ca, 46Ca i 48Ca.
Wapń i jego związki znane były od starożytności. Humphry Davy w 1808 r. wyizolował go w stanie czystym i udowodnił analitycznie, że jest pierwiastkiem.
Wapń występuje na górnych warstwach Ziemi w ilości 3,54%. Główne minerały to kalcyt, aragonit, marmury, kreda, wapienie, gips, anhydryt, dolomit, fluoryt, apatyt oraz wiele krzemianów.
Wapń jest dość aktywnym metalem i w odpowiednich warunkach reaguje z wodą, ale nie tak gwałtownie jak metale alkaliczne. Gwałtownie reaguje z większością kwasów mineralnych i wieloma organicznymi.
Najważniejsze związki wapnia to tlenek wapnia, nadtlenek wapnia, wodorotlenek wapnia oraz wiele soli jak np: węglan wapnia, azotan wapnia czy węglik wapnia.
Otrzymywanie
Metaliczny wapń jest otrzymywany przez elektrolizę stopionego chlorku wapnia lub poprzez prażenie tlenku wapnia z glinem bez dostępu powietrza:
3CaO + 2Al → Al2O3 + 3Ca
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/Wap%C5%84)
Analiza jakościowa
1) Reakcja z wodorotlenkiem sodu
Z dość stężonych roztworów soli wapnia strąca się biały wodorotlenek wapnia:
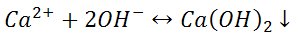
2) Reakcje z węglanami
Jony wapnia reagują z węglanami, tworząc biały osad.
![]()
Węglan wapnia rozpuszcza się łatwo w rozcieńczonych roztworach silnych kwasów i w kwasie octowym z wydzieleniem lotnego dwutlenku węgla.
![]()
3) Reakcje z jonami szczawianowymi
Jony szczawianowe wytrącają z roztworów obojętnych lub kwaśnych od kwasu octowego biały, krystaliczny osad szczawianu wapnia.
![]()
Osad rozpuszcza się w rozcieńczonym kwasie solnym, lecz praktycznie nie rozpuszcza się w kwasie octowym.
4) Reakcje z kwasem siarkowym(VI)
Osad siarczanu(VI) wapnia wytrąca się tylko ze stężonych roztworów soli wapnia. Siarczan(VI) wapnia łatwo rozpuszcza się w kwasach mineralnych i w kwasie octowym.
![]()
Siarczan wapnia rozpuszcza się na gorąco w stężonym roztworze siarczanu(VI) amonu z utworzeniem jonu kompleksowego:
![]()







