Kation miedzi(II)
 Miedź (Cu, łac. cuprum) – pierwiastek chemiczny, z grupy metali przejściowych układu okresowego. Nazwa miedzi w języku angielskim pochodzi od Cypru, gdzie w starożytności odkryto ten metal. Początkowo nazywano go metalem cypryjskim (łac. cyprum aes), a następnie cuprum.
Miedź (Cu, łac. cuprum) – pierwiastek chemiczny, z grupy metali przejściowych układu okresowego. Nazwa miedzi w języku angielskim pochodzi od Cypru, gdzie w starożytności odkryto ten metal. Początkowo nazywano go metalem cypryjskim (łac. cyprum aes), a następnie cuprum.
Posiada 26 izotopów z przedziału mas 55-80. Trwałe są tylko dwa: 63 i 65.
Występuje w skorupie ziemskiej w ilościach 55 ppm. W naturze występuje w postaci rud oraz w postaci czystej jako minerał – miedź rodzima. Miedź rodzima jest rzadko spotykana. Głównym źródłem tego metalu są minerały: – siarczki: [ chalkopiryt (CuFeS2), chalkozyn (Cu2S), bornit (Cu5FeS4)] i węglany – azuryt (Cu3(CO3)2(OH)2), malachit (Cu2CO3(OH)2).
Czysta miedź metaliczna
Miedź jest metalem barwy ceglastoczerwonej, o gęstości 8,96 g/cm³ i temperaturze topnienia 1083°C. Miedź metaliczna po wytopie i oczyszczeniu jest czerwono-brązowym, miękkim metalem o bardzo dobrym przewodnictwie cieplnym i elektrycznym. Nie ulega na powietrzu korozji, ale reaguje z zawartym w powietrzu dwutlenkiem węgla pokrywając się charakterystyczną zieloną patyną zwaną grynszpanem szlachetnym. W środowisku o dużym stężeniu dwutlenku siarki zamiast zielonej patyny pojawia się czarny nalot siarczku miedzi.
Można ją przerabiać plastycznie na zimno i na gorąco, ale w przypadku przeróbki na zimno następuje utwardzenie metalu (w wyniku zgniotu), które usuwa się przez wyżarzenie rekrystalizujące (w temp. 400-600°C). Przeróbkę plastyczną na gorąco przeprowadza się w temp. 650-800°C. Cennymi własnościami miedzi są wysoka przewodność elektryczna i cieplna oraz odporność chemiczna (z tej przyczyny miedź określa się jako metal półszlachetny).
Miedź czysta zawiera 0,01-1,0% zanieczyszczeń, zależnie od rodzaju wytwarzania, przetwarzania i oczyszczania. Za zanieczyszczenia uważa się takie pierwiastki jak: Bi, Pb, Sb, As, Fe, Ni, Sn, Zn, oraz S.
Zastosowanie miedzi
Miedź, obok żelaza odegrała wyjątkową rolę w rozwoju cywilizacji ludzkiej. Epoka brązu zawdzięcza swoją nazwę jednemu ze stopów miedzi. Pierwiastek ten znany jest od starożytności, od kiedy to był podstawowym składnikiem brązów.
Jest masowo wykorzystywana jako surowiec do produkcji przewodów elektrycznych i powszechnie w elektronice, a także w budownictwie (pokrycie dachów, elementy różnych instalacji), jako barwnik szkła oraz katalizator.
Miedź jest dodawana do wielu stopów, zarówno do stali jaki i do stopów aluminium. Jest też dodawana do srebra i złota poprawiając znacznie ich własności mechaniczne.
Miedź z cyną, cynkiem, molibdenem i innymi metalami przejściowymi tworzy cały zestaw stopów zwanych ogólnie brązami. Najbardziej znane z nich to: udający złoto tombak i posiadający bardzo dobre własności mechaniczne oraz znaczną odporność na korozję mosiądz. Stopy miedzi stosuje się do wyrobu kosztownej armatury, elementów precyzyjnych urządzeń mechanicznych i w jubilerstwie.
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/Mied%C5%BA)
Analiza jakościowa
1) Reakcja z amoniakiem
Pod wpływem amoniaku kationy miedzi(II) tworzą galaretowaty niebieski osad hydroksosoli, rozpuszczalny w nadmiarze odczynnika barwy szafirowej.
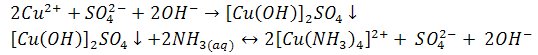
2) Reakcje z roztworem wodorotlenku sodu
Powstaje niebieski osad, nierozpuszczalny w nadmiarze odczynnika.
![]()
3) Reakcje z jonami tiocyjanianowymi
Jony tiocyjanianowe wytrącają czarny osad, który po dodaniu jonów siarczanowych(IV) przechodzi w biały osad tiocyjanianu miedzi(I). Osad rozpuszcza się w nadmiarze jonów tiocyjanianowych, przechodząc w bezbarwny jon kompleksowy ditiocyjanomiedzian(I).
![]()
4) Reakcje z jonami tetratiocyjanortęcianu(II)
Wytrąca się żółto zielony osad.
![]()
W obecności niewielkiej ilości jonów cynku lub kadmu następuje współwytrącanie i tworzą się trudno rozpuszczalne sole. Barwa tych soli zależy od stężenia jonów miedzi(II) w roztworze i zmienia się od zielonej do fioletowej.
5) Reakcja z aniliną
Anilina z jonami miedzi(II) daje zielono zabarwioną sól wewnątrz kompleksową.










