Kation ołowiu(II)
 Ołów (Pb, łac. plumbum) – pierwiastek chemiczny, metal z bloku p w układzie okresowym.
Ołów (Pb, łac. plumbum) – pierwiastek chemiczny, metal z bloku p w układzie okresowym.
Ołów występuje w skorupie ziemskiej w ilości 0,6 ppm. Najważniejszymi minerałami ołowiu są:
- galena PbS
- anglezyt PbSO4
- cerusyt PbCO3
- piromorfit Pb5(PO4)3Cl
- mimetezyt Pb5(AsO4)3Cl
Ołów znalazł szerokie zastosowanie w przemyśle. Stosowany jest do produkcji:
- płyt akumulatorowych, baterii;
- kabli, rur;
- amunicji (rdzeni pocisków karabinowych);śrutu myśliwskiego i do wiatrówek.
- farb – białych i czerwonych;
- szkła ołowiowego „kryształowego”;
- dodatku przeciwstukowego do benzyn (czteroetylku ołowiu);
- w przemyśle drukarskim do wyrobu stopu czcionek;
- do wykładania komór, wież i wanien przy produkcji kwasu siarkowego;
- stosuje się go jako ekrany zabezpieczające przed promieniowaniem rentgenowskim i promieniowaniem gamma;
- w starożytnym Rzymie był używany do produkcji rur wodociągowych.
Tetraetyloołów Pb(C2H5)4 (dawna nomenklatura: czteroetylek ołowiu) był stosowany jako środek podnoszący liczbę oktanową benzyn silnikowych, Związek ten był głównym sprawcą emisji tlenków ołowiu do atmosfery w postaci aerozolu. Ostatnio dodatek tetraetyloołowiu w paliwach został praktycznie wyeliminowany.
Sole i tlenki tego pierwiastka są trucizną kumulującą się w organizmie. Toksyczne skutki działania ołowiu na organizm ludzki określa się nazwą ołowica. Zaabsorbowane związki ołowiu przenikają do krwiobiegu, gdzie ołów wbudowuje się do czerwonych krwinek – średni czas przebywania wynosi 30 dni. Stąd 25-40% jego zawartości przenika do tkanek miękkich, około 15% do kości, a pozostała ilość jest wydalana. Czas przybywania w tkankach miękkich wynosi około 30 dni, a w kościach 40-90 lat u dorosłego człowieka. W kościach kumulowany jest w postaci związków koloidalnych i krystalicznych, może być z nich uwalniany pod wpływem zaburzeń metabolicznych lub stresu. Ołów silnie wiąże się z wieloma biopolimerami, takimi jak: białka, enzymy, RNA, DNA. w ten sposób ulega zaburzeniu wiele przemian metabolicznych. Skutkami toksyczności są: zaburzenia tworzenia krwi, nadciśnienie tętnicze, neuropatia, a także uszkodzenia mózgu.
Udowodniono wchłanianie ołowiu przez skórę. Alkilowe związki ołowiu łatwiej wchłaniają się przez skórę niż nieorganiczne związki ołowiu.
Kationy Pb2+ należą do I grupy kationów, a także częsciowo do grupy IIa.
Ołów jest substancją toksyczną. Po wprowadzeniu go do organizmu pojawia się znużenie, zmęczenie, porażenie mięśni, szara obwódka wokół zębów, kolka ołowicza. Jednocześnie występuje białkomocz, krwiomocz oraz zaburzenia mózgowe. Leczenie jest głównie szpitalne i polega na podawaniu odtrutek i wysokich dawek witaminy B1 i B12. Jednak najważniejsze znaczenie ma odpowiednia higiena pracy i właściwe odżywianie.
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/O%C5%82%C3%B3w)
Analiza jakościowa
1) Reakcja z wodą amoniakalną
Pod wpływem amoniaku kationy ołowiu(II) tworzą biały, nierozpuszczalny w nadmiarze odczynnika osad wodorotlenku ołowiu(II).
![]()
2) Reakcja z wodorotlenkiem sodu.
Kationy ołowiu(II) tworzą biały osad wodorotlenku.
![]()
Osad jest rozpuszczalny w nadmiarze odczynnika, tworzy tetrahydroksoołowian(II).
![]()
3) Reakcje z jodkiem potasu
Jony jodkowe wytrącają żółty osad jodku ołowiu(II). Osad rozpuszcza się w nadmiarze odczynnika z utworzeniem tetrajodoołowianu(II).
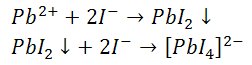
4) Reakcje z chromianem(VI) potasu i dichromianem(VI) potasu
Jony chromianowe i dichromianowe wytrącają żółty osad chromianu(VI) ołowiu(II).
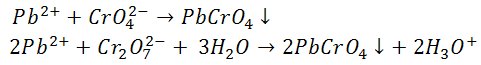
Osad nie rozpuszcza się w kwasie octowym i amoniaku,
natomiast rozpuszcza się w rozcieńczonych roztworach silnych kwasów i wodorotlenków.
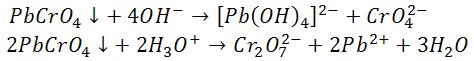
5) Reakcja z kwasem siarkowym(VI) i rozpuszczanie osadów
Jony siarczanowe(VI) wytrącają biały osad siarczanu(VI) ołowiu(II).
Osad ten jest rozpuszczalny w:
a) wodorotlenku sodu
![]()
b) stężonym roztworze octanu amonu
![]()
c) stężonym roztworze kwasu siarkowego(VI) na gorąco
![]()













