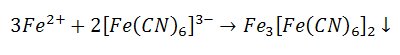Kation żelaza(II)
 Żelazo (Fe, łac. ferrum) – metal z VIII grupy pobocznej. Posiada 25 izotopów z przedziału mas 45 – 69. Trwałe są izotopy 54, 56, 57 i 58. Najwięcej jest izotopu 56 (92%).
Żelazo (Fe, łac. ferrum) – metal z VIII grupy pobocznej. Posiada 25 izotopów z przedziału mas 45 – 69. Trwałe są izotopy 54, 56, 57 i 58. Najwięcej jest izotopu 56 (92%).
Występowanie w skorupie ziemskiej
Występuje w skorupie ziemskiej w ilości ok. 6% w minerałach takich jak np.:
- czerwony hematyt (Fe2O3),
- czarny magnetyt (Fe3O4),
- syderyt (FeCO3),
- limonit,
- getyt (FeO(OH),
- piryt (FeS2)
- arsenopiryt (FeAsS)
- i wiele innych.
W wydobyciu rud żelaza w 2003 roku, wynoszącym ogółem ok. 1 mld ton, przodowały: Chiny (240 mln ton), Brazylia (215 mln ton), Australia (ok. 190 mln ton), Rosja (90 mln ton) i Indie (80 mln ton).
W Polsce zasobów żelaza w okolicach Suwałk nie wydobywa się w związku z groźbą zaistnienia katastrofy ekologicznej oraz z uwagi na głębokie położenie złóż.
Żelazo znane było już cywilizacjom starożytnym.
Oprócz minerałów, duże znaczenie technologiczne mają karbonylkowe kompleksy żelaza, które otrzymuje się z chlorków żelaza i które są katalizatorami licznych reakcji organicznych. Żółty chlorek żelaza(II) o kwaskowym smaku, jest podawany przy niedokrwistości.
Formy występowania
Czyste żelazo jest lśniącym, srebrzystym i miękkim metalem, który ulega łatwo korozji. Od wieków jest stosowane w formie stopów z węglem zwanym żeliwem i stalą oraz stopów z manganem, chromem, molibdenem, wanadem i wieloma innymi (są to tzw. stale stopowe).
Żelazo występuje w dwóch odmianach alotropowych:
- żelazo α – w zakresie wysokotemperaturowym oznaczana niekiedy α lub α(δ).
- żelazo γ
Jedynie żelazo α posiada własności ferromagnetyczne.
Przemiana alotropowa żelaza α w żelazo γ zachodzi w temperaturze 723°C przy schładzaniu lub 728°C przy ogrzewaniu.
Przemiana alotropowa żelaza γ w żelazo α(δ) zachodzi w temperaturze 1400°C.
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/%C5%BBelazo)
Analiza jakościowa
1) Reakcja z amoniakiem
Powstaje zielonkawy osad wodorotlenku żelaza(II), który w warunkach tlenowych utlenia się do wodorotlenku żelaza(III) o zabarwieniu czerwono-brunatnym.
![]()
2) Reakcja z roztworem wodorotlenku sodu
Powstaje zielonkawy osad wodorotlenku żelaza(II), który w warunkach tlenowych utlenia się do wodorotlenku żelaza(III) o zabarwieniu czerwono-brunatnym.
![]()
3) Reakcja z heksacyjanożelazianem(II)
Tworzy on z jonami żelaza(II) ciemnoniebieski, trudno rozpuszczalny związek zwany błękitem Turnbulla.