Kation chromu(III)
 Chrom (Cr, łac. chromium) – pierwiastek chemiczny, metal przejściowy z bloku d układu okresowego. Posiada 13 izotopów, od 45Cr do 57Cr, z czego trwałe są izotopy 50, 52, 53 i 54.
Chrom (Cr, łac. chromium) – pierwiastek chemiczny, metal przejściowy z bloku d układu okresowego. Posiada 13 izotopów, od 45Cr do 57Cr, z czego trwałe są izotopy 50, 52, 53 i 54.
Został odkryty w roku 1797 przez Louisa Nicolasa Vauqellina.
Właściwości
Chrom metaliczny jest srebrzystoszarym metalem(z błękitnym połyskiem w świetle), bardzo odpornym na korozję na skutek pasywacji tlenkiem chromu(III) w reakcji z tlenem z powietrza. W reakcji ze stężonym kwasem azotowym(V) chrom ulega pasywacji
Zastosowania
Ze względu na swoje antykorozyjne właściwości, chrom jest stosowany jako zewnętrzna warstwa pokrywająca elementy stalowe, poprawiająca ich wygląd oraz chroniąca przed korozją, jest także składnikiem stali nierdzewnych (chromowych). Stal taka jest stosowana m.in. w armaturze łazienkowej lub w samochodach, ale także w produkcji samolotów, broni i pojazdów wojskowych.
Związki
Najważniejszym związkiem jest FeCr2O4(FeO*Cr2O3) czyli chromit, posiadający silne własności diamagnetyczne, który jest stosowany jako aktywna warstwa w taśmach magnetycznych.
Roztwory soli Cr(III) i Cr(VI) posiadają bardzo intensywne barwy (zieloną i pomarańczową) co jest wykorzystywane w fotochemii i technikach kolorymetrycznych.
Mieszanina Na2Cr2O7 z kwasem siarkowym jest nazywana chromianką i służy do mycia szkła laboratoryjnego.
Tlenek chromu(III) (zieleń chromowa) jest używany jako pigment.
Sole chromu(VI) są toksyczne i mają właściwości rakotwórcze.
Występowanie
Występuje w skorupie ziemskiej w ilościach ok. 102 ppm, głównie w postaci minerałów chromitu i krokoitu.
Z punktu widzenia odżywiania najlepszym źródłem chromu są drożdże piekarskie, a także kolby kukurydzy, gotowana wołowina, jabłka, kasze, chleb gruboziarnisty oraz płatki zbożowe.
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/Chrom)
Analiza jakościowa
1) Reakcja z amoniakiem
Powstaje szaro-zielony osad wodorotlenku chromu(III), rozpuszczalny w stężonym amoniaku z utworzeniem kompleksu aminowego chromu o fiołkowym zabarwieniu:
![]()
Ogrzanie roztworu do wrzenia powoduje rozkład kompleksu i ponowne wytrącenie wodorotlenku chromu(III).
2) Reakcje z roztworem wodorotlenku sodu
Powstaje szaro-zielony osad wodorotlenku chromu(III), rozpuszczalny w nadmiarze odczynnika z utworzeniem kompleksu o zielonym zabarwieniu. Rozcieńczenie i ogrzanie chromianów(III) powoduje ponowne wytrącenie wodorotlenku chromu(III).
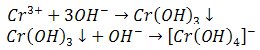
3) Otrzymywanie nadtlenku chromu
3%-owy roztwór nadtlenku wodoru tworzy z jonami dichromianowymi(VI) w środowisku kwaśnym nadtlenek chromu ekstrahowany przez alkohol amylowy z utworzeniem niebieskiego zabarwienia.
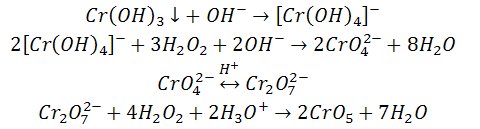
4) Reakcja utleniania
Wykorzystujemy w tej reakcji zmianę barwy roztworu z zielonej na żółtą (w środowisku alkalicznym) lub pomarańczową (w środowisku kwaśnym). Utleniamy jony chromu(III) nadtlenkiem wodoru i ogrzewamy.
![]()
5) Reakcja z aniliną
Jony chromianowe(VI) wobec stężonego kwasy siarkowego(VI) utleniają anilinę dając tzw. czerń anilinową o barwie od zielonej do czarnej. Jeżeli w próbie znajdują się jony chromu(III) należy utlenić je w środowisku alkalicznym wodą utlenioną. Nadmiar utleniacza (nadtlenek wodoru również reaguje z aniliną) odpędza się poprzez ogrzewanie. Próbę zadaje się stężonym kwasem siarkowym(VI) i dodaje kroplę aniliny. Powstające zielone zabarwienie świadczy o obecności chromu.











