Kation glinu
 Glin (Al, łac. aluminium) – pierwiastek chemiczny, metal z bloku p układu okresowego. Jedynym izotopem stabilnym jest 27Al. Glin jest trzecim, najpowszechniej występującym pierwiastkiem na powierzchni Ziemi. Od niego wywodzi się dawna nazwa pierwszej warstwy globu – SiAl.
Glin (Al, łac. aluminium) – pierwiastek chemiczny, metal z bloku p układu okresowego. Jedynym izotopem stabilnym jest 27Al. Glin jest trzecim, najpowszechniej występującym pierwiastkiem na powierzchni Ziemi. Od niego wywodzi się dawna nazwa pierwszej warstwy globu – SiAl.
Sole i tlenki glinu znane były od zarania dziejów. Uwodniony, mieszany siarczan tego pierwiastka, ałun, był używany jako środek antyseptyczny przez starożytnych Greków. Istnienie tego pierwiastka i nazwę zasugerował Louis-Bernard Guyton de Morveau w 1761 r. W 1807 podobną sugestię wyraził sir Humphry Davy, który zaproponował współczesną nazwę. Istnieją kontrowersje na temat tego kto pierwszy wyodrębnił ten pierwiastek w stanie czystym. Według jednych źródeł był to Friedrich Wöhler w 1827 r. wg innych Hans Christian Ørsted w 1825 r.
Właściwości chemiczne
Glin występuje na +3 stopniu utlenienia, bardzo rzadko również na +1 i +2. W stanie czystym powoli utlenia się na powietrzu, ulegając pasywacji.
Podgrzewany reaguje z tlenem obecnym w powietrzu tworząc tlenek. Glin łatwo roztwarza się w mocnych zasadach, takich jak NaOH lub KOH wypierając wodór i przechodząc w tetrahydroksyglinian:
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑.
W kwasie solnym i w rozcieńczonym kwasie siarkowym roztwarza się wypierając wodór, natomiast reakcja ze stężonym kwasem siarkowym i rozcieńczonym kwasem azotowym przebiega inaczej – wydziela się odpowiednio dwutlenek siarki i dwutlenek azotu. W stężonym kwasie azotowym glin ulega pasywacji.
Zastosowanie
Ze względu na swoje właściwości, takie jak mała gęstość i odporność na korozję, stopy glinu z miedzią i molibdenem zwane duraluminium znalazły wiele zastosowań i są używane do wyrobu szerokiej grupy produktów – od puszek do napojów do części statków kosmicznych. Czysty, krystaliczny glin jest kruchy i łamliwy.
Sproszkowany glin używany jest także w hutnictwie do otrzymywania metali z ich tlenków w procesie aluminotermii. Użyta w tym procesie mieszanina glinu oraz tlenków metali jest znana pod nazwą termit. Używany do produkowania materiałów wybuchowych w wojsku oraz w modelarstwie rakietowym.
Stosowany jest również w przemyśle spożywczym, jako barwnik metaliczny pozyskiwany z boksytów. Używany jest przy srebrnych dekoracjach ciast i tortów. Parlament Europejski uznał, że dodawanie aluminium powinno być zakazane, ponieważ ma związek z chorobą Alzheimera.
W pirotechnice amatorskiej glin jest używany do robienia domowych petard. Sproszkowany glin zmieszany ze sproszkowanym nadmanganianem potasu tworzy szybko- i łatwopalną mieszankę, która po zapaleniu wybucha z wydzieleniem dużej ilości dymu.
Tak zwane aluminium utwardzane dyspersyjnie jest wykorzystywane w produkcji koszulek elementów paliwowych i konstrukcyjnych rdzeni reaktorów jądrowych.
Najważniejsze związki glinu
Najważniejsze związki glinu to tlenek glinu i amfoteryczny wodorotlenek glinu. Glin tworzy też wodorek, a tetrahydroglinian litu LiAlH4 jest powszechnie stosowanym w chemii organicznej silnym środkiem redukującym. Duże znaczenie przemysłowe mają też aluminoksany, a zwłaszcza MAO (metylowy aluminoksan), z którego produkuje się sita molekularne, oraz powszechnie wykorzystuje jako stałe podłoże dla wielu katalizatorów. Glina i kaolin powszechnie wykorzystywane przy produkcji ceramiki to złożone mieszaniny glino-krzemianów.
źródło: Wikipedia.pl (http://pl.wikipedia.org/wiki/Glin)
Analiza jakościowa
1) Reakcja z amoniakiem
Wytrąca się biały galaretowaty osad wodorotlenku glinu, częściowo rozpuszczalny w nadmiarze odczynnika.
![]()
2) Reakcja z wodorotlenkiem sodu
Wytrąca się biały galaretowaty osad wodorotlenku glinu, rozpuszczalny w nadmiarze odczynnika.
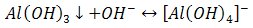
3) Reakcja z aluminonem
Osad wodorotlenku glinu rozpuszcza się z kwasem solnym i dodaje octanu amonu do osiągnięcia pH ok. 5. Następnie dodaje się aluminonu i ogrzewa. Wobec małych ilości glinu roztwór barwi się na czerwono.




